Nu ne vom conduce într-un cadru strict de la bun început și vom descrie termenul cât mai simplu posibil: procesul de oxidare a substanțelor organice (organice; acestea sunt, de exemplu, proteine, grăsimi și carbohidrați) se numește reacție, ca urmare a căreia volumul de oxigen (O2) crește și volumul de hidrogen scade ( H2).
Substanțele organice sunt diferiți compuși chimici care conțin carbon (C). Excepțiile sunt acidul carbonic (H2CO3), carburile (de exemplu, carborundul SiC, cementita Fe3C), carbonații (de exemplu, calcitul CaCO3, magnezita MgCO3), oxizii de carbon, cianurile (cum ar fi KCN, AgCN). Substanțele organice interacționează cu cel mai renumit oxidant, oxigenul O2, formând în același timp apă H2O și dioxid de carbon CO2.

Procesul de oxidare a materiei organice
În mod logic vorbind, deoarece procesul de oxidare completă este arderea, atunci procesul incomplet este oxidarea materiei organice, deoarece sub acest efect, substanța nu se aprinde, ci doar încălzirea acesteia (însoțită de eliberarea unei anumite cantități de energie sub formă de ATP - trifosfat de adenozină - și căldură Q ).
Reacția de oxidare organică nu este prea complicată, așa că încep să o dezasambleze la începutul cursului de chimie, iar elevii absorb rapid informațiile, dacă, desigur, depun cel puțin un efort. Am învățat deja ce este acest proces și acum trebuie să aprofundăm însăși esența problemei. Deci, cum are loc reacția și ce este?
Oxidarea materiei organice este un fel de tranziție, transformarea unei clase de compuși în alta. De exemplu, întregul proces începe cu oxidarea unei hidrocarburi saturate și transformarea acesteia într-una nesaturată, apoi substanța rezultată este oxidată până la formarea alcoolului; alcoolul, la rândul său, formează o aldehidă, iar acidul carboxilic „curge” din aldehidă. Ca rezultat al întregii proceduri, obținem dioxid de carbon (când scrieți ecuația, nu uitați să puneți săgeata corespunzătoare ↑) și apă.
Aceasta este o reacție redox și, în majoritatea cazurilor, materia organică prezintă proprietăți reducătoare, iar ea însăși este oxidată. Pentru fiecare element implicat, se determină propria sa clasificare - este fie un agent reducător, fie un agent oxidant și dăm un nume pe baza rezultatului OVR.
Capacitatea substanțelor organice de a se oxida
Acum știm că un agent oxidant care ia electroni și are o sarcină negativă și un agent reducător care donează electroni și are o sarcină pozitivă participă la reacția redox (ORR). Cu toate acestea, nu orice substanță poate intra în procesul pe care îl luăm în considerare. Pentru a ușura înțelegerea, luați în considerare punctele.
Compușii nu sunt oxidați:
- Alcani - parafinele sau hidrocarburile saturate sunt numite diferit (de exemplu, metan având formula CH4);
- Arenele sunt compuși organici aromatici. Dintre acestea, benzenul nu este oxidat (în teorie, această reacție poate fi efectuată, dar după mai mulți pași lungi; benzenul nu poate fi oxidat singur);
- Alcoolii terțiari sunt alcool în care gruparea hidroxi OH se leagă de un atom de carbon terțiar;
- Fenol - un alt nume pentru acidul carbolic și în chimie este scris ca formula C6H5OH.
Exemple de substanțe organice oxidabile:
- Alchene;
- Alcine (ca rezultat, vom urmări formarea unei aldehide, acid carboxilic sau cetonă);
- Alcadienele (se formează fie alcooli polihidrici, fie acizi);
- Cicloalcani (în prezența unui catalizator, se formează acid dicarboxilic);
- Arene (orice substanțe care au o structură similară cu benzenul, adică omologii săi pot fi oxidate în acid benzoic);
- Alcooli primari, secundari;
- Aldehidele (au capacitatea de a oxida apoi carbohidrații);
- Amine (oxidarea duce la formarea unuia sau mai multor compuși cu o grupare nitro NO2).
Oxidarea substanțelor organice în celula organismelor vegetale, animale și umane
Aceasta este cea mai importantă întrebare nu numai pentru acei oameni interesați de chimie. Toată lumea ar trebui să aibă acest tip de cunoștințe pentru a-și forma o idee corectă despre diferite procese din natură, despre valoarea oricăror substanțe din lume și chiar despre sine - o persoană.
Din cursurile de biologie școlară, probabil știți deja că oxidarea materiei organice joacă un rol biologic important în corpul uman. Ca urmare a reacțiilor redox, BJU (proteine, grăsimi, carbohidrați) sunt defalcate: căldura, ATP și alți purtători de energie sunt eliberați în celule, iar corpul nostru este întotdeauna asigurat cu o cantitate suficientă pentru a efectua acțiuni și funcționarea normală a sistemelor de organe.
Cursul acestui proces ajută la menținerea unei temperaturi constante a corpului în organism nu numai a unei persoane, ci și a oricărui alt animal cu sânge cald și ajută, de asemenea, la reglarea constanței mediului intern (aceasta se numește homeostazie), a metabolismului, asigură munca de înaltă calitate a organelor celulare, a organelor și, de asemenea, efectuează multe altele funcțiile necesare.
În timpul fotosintezei, plantele absorb dioxidul de carbon dăunător și formează oxigen, care este necesar pentru respirație.
Oxidarea biologică a substanțelor organice poate avea loc exclusiv cu utilizarea diferiților purtători de electroni și enzime (fără acestea, acest proces ar dura foarte mult).
Rolul oxidării organice în industrie
Dacă vorbim despre rolul oxidării materiei organice în industrie, atunci acest fenomen este utilizat în sinteza petrochimică, în activitatea bacteriilor acidului acetic (cu oxidare organică incompletă, acestea formează o serie de substanțe noi), iar în unele cazuri cu materie organică, este posibilă și producerea de substanțe explozive.
Principiile ecuației în chimia organică
În chimie, nu se poate face fără elaborarea unei ecuații - acesta este un fel de limbaj al acestei științe, în care toți oamenii de știință ai planetei, indiferent de naționalitate, se pot vorbi și înțelege reciproc.
Cu toate acestea, cele mai mari dificultăți sunt cauzate de întocmirea de ecuații atunci când studiul chimiei organice este în față.
Este nevoie de o perioadă foarte lungă de timp pentru a dezasambla acest subiect, așa că aici este selectat doar un scurt algoritm de acțiuni pentru rezolvarea unui lanț de ecuații cu câteva explicații:
- În primul rând, ne uităm imediat la câte reacții apar într-un proces dat, le numărăm. De asemenea, determinăm clasele, numele substanțelor de pornire și substanțelor care se formează în cele din urmă;
- În al doilea rând, este necesar să scriem una câte una toate ecuațiile și să aflăm tipul reacțiilor lor (compus, descompunere, schimb, substituție) și condițiile.
- După aceea, puteți crea solduri electronice și nu uitați să plasați coeficienții.
Reacții de oxidare a substanțelor organice și a produselor lor finale de formare
Ca exemple ilustrative, luați în considerare în continuare reacțiile redox ale celor mai frecvente clase de compuși organici
Oxidarea benzenului
Chiar și în cele mai agresive condiții, benzenul nu este supus oxidării. Cu toate acestea, omologii benzenului pot fi oxidați sub influența unei soluții de permanganat de potasiu într-un mediu neutru pentru a forma benzoat de potasiu.
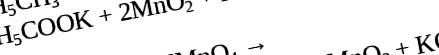
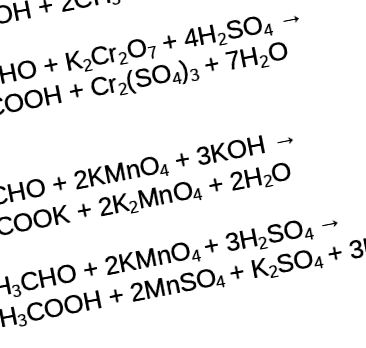
Dacă schimbăm mediul neutru într-unul acid, atunci omologii benzenului pot fi oxidați cu permanganat sau dicromat de potasiu cu formarea finală a acidului benzoic.
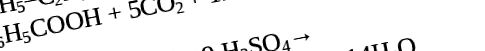
Formula pentru formarea acidului benzoic
Oxidarea alchenelor
În oxidarea alchenelor cu oxidanți anorganici, produsele finale sunt așa-numiții alcooli dihidrici - glicogeni. Agenții reducători ai acestor reacții sunt atomii de carbon.
Un exemplu ilustrativ în acest sens este reacția chimică a unei soluții de permanganat de potasiu în legătură cu un mediu alcalin slab.
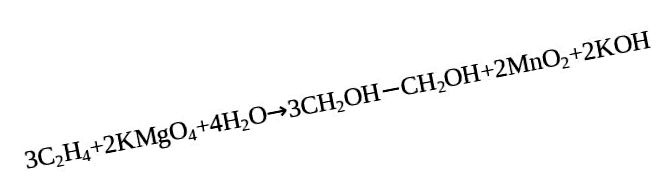
Condițiile de oxidare agresivă duc la distrugerea lanțului de carbon la o legătură dublă cu produsele finale de formare sub formă de doi acizi. Mai mult, dacă mediul cu un conținut ridicat de alcali, se formează două săruri. De asemenea, acidul și dioxidul de carbon se pot forma ca produse datorită degradării lanțului de carbon, dar într-un mediu puternic alcalin, sărurile de carbonat sunt produse ale reacției oxidative.
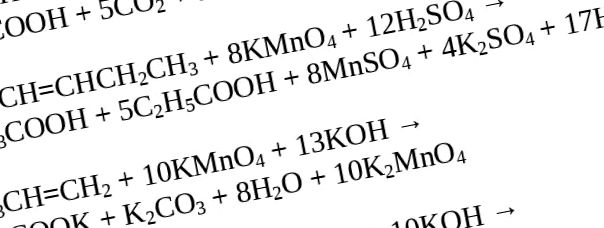
Alchenele sunt capabile de oxidare atunci când sunt imersate într-un mediu acid de dicromat de potasiu într-un mod similar cu cel dat în primele două exemple.
Oxidarea alchinelor
Spre deosebire de alchene, alchinele se oxidează într-un mediu mai agresiv. Distrugerea lanțului de carbon are loc de-a lungul unei triple legături. O proprietate comună cu alchenele sunt reductorii lor reprezentați de atomii de carbon.
Produsele de reacție la ieșire sunt dioxidul de carbon și acizii. Permanganatul de potasiu plasat într-un mediu acid va fi un agent oxidant.
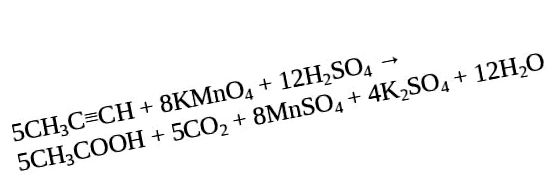
Produsele de oxidare ale acetilenei, când sunt imersate într-un mediu neutru cu permanganat de potasiu, sunt oxalat de potasiu.
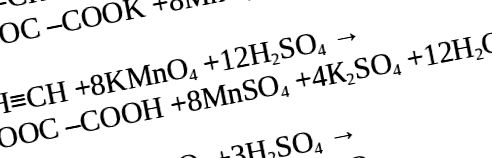
Când un mediu neutru este transformat într-o reacție acidă, oxidarea continuă la formarea de dioxid de carbon sau acid oxalic.
Oxidarea aldehidelor
Aldehidele sunt ușor oxidate datorită proprietăților lor puternice de reducere. Ca oxidanți ai aldehidelor, permanganatul de potasiu cu dicromatul de potasiu se poate distinge, ca în versiunile anterioare, precum și soluția de hidroxid de argint diamină - [Ag (NH3) 2] OH, care este în principal caracteristică pentru aldehide, și hidroxid de cupru - Cu (OH) 2. O condiție importantă pentru reacția de oxidare a aldehidelor este efectul temperaturii.
Videoclipul arată cum se determină prezența aldehidelor în reacția cu hidroxid de cupru.
Aldehidele pot fi oxidate în acizi carboxilici sub influența hidroxidului de argint diamină sub formă de soluție cu eliberare de săruri de amoniu. Această reacție se numește „oglinda de argint”.
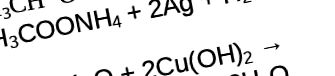
Următorul videoclip arată o reacție interesantă, care se numește „oglinda argintie”. Acest experiment se desfășoară în interacțiunea glucozei, care este și o aldehidă, cu o soluție de amoniac de argint.
Oxidarea alcoolilor
Produsul de oxidare al alcoolilor depinde de tipul de atom de carbon de care este legat grupul OH al alcoolului. Dacă grupul este legat de un atom de carbon primar, atunci produsul de oxidare va fi aldehidele. Dacă gruparea OH din alcool este legată de un atom de carbon secundar, atunci produsul de oxidare este cetonele.
Aldehidele, la rândul lor formate în timpul oxidării alcoolilor, pot fi apoi oxidate pentru a forma acizi. Acest lucru se realizează prin oxidarea alcoolilor primari cu dicromat de potasiu într-un mediu acid la punctul de fierbere al aldehidei, care, la rândul său, nu au timp să se oxideze în timpul evaporării.
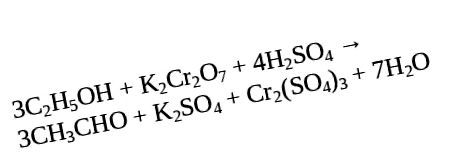
Sub condiția prezenței excesive a unor oxidanți precum permanganatul de potasiu (KMnO4) și dicromatul de potasiu (K2Cr2O7), în aproape orice condiții, alcoolii primari pot fi oxidați cu eliberarea acizilor carboxilici și cetonii, la rândul lor, în alcooli secundari, exemple de reacții ale cărora produsele de formare vor fi luate în considerare mai jos.
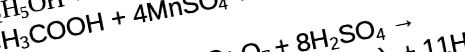
Etilenglicolul sau așa-numitul alcool dihidric, în funcție de mediu, pot fi oxidate pentru a forma produse precum acidul oxalic sau oxalatul de potasiu. Dacă etilen glicolul se află într-o soluție de permanganat de potasiu cu adăugarea unui acid, se formează acid oxalic, dacă alcoolul dihidric se află în aceeași soluție de permanganat de potasiu sau dicromat de potasiu, dar într-un mediu neutru, atunci se formează oxalat de potasiu. Luați în considerare aceste reacții.
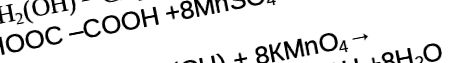
Am aflat tot ce trebuie înțeles la început și chiar am început să analizăm un subiect atât de dificil precum rezolvarea și întocmirea ecuațiilor. În concluzie, putem spune doar că practica echilibrată și cursurile frecvente vă vor ajuta să consolidați rapid materialul învățat și să învățați cum să rezolvați problemele.