Însuși cuvântul „atom” a fost menționat pentru prima dată în lucrările filosofilor din Grecia Antică, iar în traducere înseamnă „indivizibil”. Lipsit de dispozitive moderne, filosoful Democrit, folosind logica și observația, a ajuns la concluzia că orice substanță nu poate fi infinit fragmentată și, ca urmare, ar trebui să rămână un fel de particulă de materie indivizibilă - un atom de materie.
Și dacă nu ar exista atomi, atunci orice substanță sau obiect ar putea fi distrus complet. Democrit a devenit fondatorul atomismului - o întreagă doctrină care se baza pe conceptul de atom.

Ce este un atom?
Un atom este cea mai mică particulă neutră electric din orice element chimic. Se compune dintr-un nucleu încărcat pozitiv și un înveliș format din electroni încărcați negativ. Un nucleu încărcat pozitiv este nucleul unui atom. Ocupă o mică parte a spațiului din centrul atomului și aproape toată masa atomului și toată sarcina pozitivă sunt concentrate în el.
Din ce este făcut un atom?
Particulele elementare alcătuiesc nucleul unui atom - neutroni și protoni, iar electronii se mișcă în orbitalele închise din jurul nucleului atomic.
Ce este un neutron?
Un neutron (n) este o particulă neutră elementară, a cărei masă relativă este 1,00866 unitate de masă atomică (amu).
Ce este un proton?
Protonul (p) este o particulă elementară, a cărei masă relativă este 1,00728 unitate de masă atomică, o sarcină pozitivă de +1 și o rotire de 1/2. Protonul (tradus din greacă ca bază, primul) se referă la barioni. În nucleul unui atom, numărul de protoni este egal cu numărul ordinal al unui element chimic din Tabelul periodic al D.I. Mendeleev.
Ce este un electron?
Un electron (e–) este o particulă elementară, a cărei masă este 0,00055 amu; sarcină electronică condiționată: - 1. Numărul de electroni dintr-un atom este egal cu sarcina nucleului atomic (corespunde numărului ordinal al unui element chimic din tabelul periodic al lui Mendeleev).
În jurul nucleului, electronii se mișcă pe orbitali, care sunt strict definiți și se formează un nor de electroni.Regiunea spațiului din jurul nucleului atomic, unde electronii sunt prezenți cu o probabilitate mai mare de 90%, determină forma norului de electroni.
Norul de electroni al unui electron p seamănă cu o ganteră în aparență; doar șase electroni pot fi la maxim pe trei orbitali p.
Norul s-electron este o sferă; la subnivelul energiei s, numărul maxim de electroni care pot fi acolo este 2.
Orbitalii sunt descriși sub forma unui pătrat, sub sau deasupra acestuia, sunt prescrise valorile numerelor cuantice principale și secundare, care descriu acest orbital.Această înregistrare se numește o formulă electronică grafică. Arată așa:

Săgețile din această formulă reprezintă electronul. Direcția săgeții corespunde cu direcția de rotație - acesta este momentul magnetic al electronului. Electronii cu rotiri opuse (în imagine sunt săgeți direcționate în direcții opuse) sunt numiți împerecheați.
Configurațiile electronice ale atomilor elementelor pot fi reprezentate sub formă de formule, în care:
- Indicați simboluri de subnivel;
- Gradul unui simbol arată numărul de electroni ai unui subnivel dat;
- Coeficientul din fața simbolului unui subnivel indică apartenența sa la acest nivel.
Determinarea numărului de neutroni
Pentru a determina numărul de neutroni N din nucleu, trebuie să utilizați formula:
N = A-Z, unde A este numărul de masă; Z - sarcina nucleului, care este egală cu numărul de protoni (numărul ordinal al unui element chimic din tabelul periodic).
De regulă, parametrii nucleului sunt scrise după cum urmează: mai sus este numărul masei, iar în partea din stânga jos a simbolului elementului, se scrie sarcina nucleului.Arată așa:
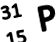
Această intrare înseamnă următoarele:
- Numărul de masă este 31;
- Sarcina nucleului (și, în consecință, numărul de protoni) pentru atomul de fosfor este 15;
- Numărul de neutroni este 16. Se calculează astfel: 31-15 = 16.
Numărul de masă corespunde aproximativ cu masa atomică relativă a nucleului. Acest lucru se datorează faptului că masele neutronului și protonului practic nu diferă.
Structura atomilor primelor zece elemente chimice ale tabelului periodic
Mai jos am prezentat o parte a tabelului în care structura cochiliei de electroni a atomilor din primele douăzeci de elemente ale Tabelului periodic al elementelor chimice din D.I. Mendeleev. Tabelul complet al formulelor electronice ale atomilor este prezentat într-o publicație separată a noastră.

Elementele chimice în al căror atom este umplut subnivelul p se numesc elemente p. Electronii pot fi de la 1 la 6.
Elementele chimice în atomii cărora subnivelul s al nivelului exterior este completat cu 1 sau 2 electroni se numesc elemente s.
Numărul de straturi electronice dintr-un atom al unui element chimic este egal cu numărul perioadei.
Regula lui Hund
Există regula lui Hund, conform căreia electronii sunt situați în același tip de orbitali de același nivel de energie, astfel încât rotirea totală să fie maximă posibilă. Aceasta înseamnă că, atunci când subnivelul de energie este umplut, fiecare electron ocupă mai întâi o celulă separată și abia apoi începe procesul de conectare a acestora.
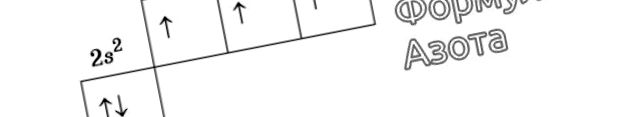
Reprezentarea grafică a formulei electronice a azotului
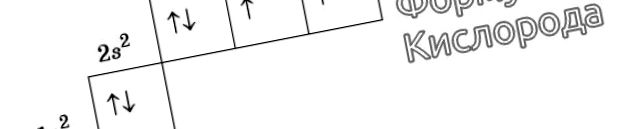
Reprezentarea grafică a formulei electronice a oxigenului
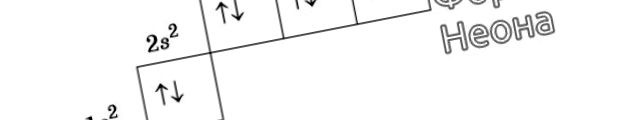
Reprezentarea grafică a formulei electronice a neonului
De exemplu, la un atom de azot, toți electronii p vor ocupa celule separate, în timp ce oxigenul își va începe asocierea, care va fi complet complet în neon.
Ce sunt izotopii
Izotopii sunt atomi ai aceluiași element care conțin același număr de protoni în nucleele lor, dar numărul de neutroni va fi diferit. Izotopii sunt cunoscuți pentru toate elementele.
Din acest motiv, masele atomice ale elementelor din sistemul periodic sunt media numerelor de masă ale amestecurilor naturale de izotopi și diferă de valorile întregi.
Există ceva mai puțin decât nucleul unui atom
Să rezumăm. Masa atomică a amestecurilor naturale de izotopi nu poate servi ca principală caracteristică a unui atom și, în consecință, a unui element.
O caracteristică similară a unui atom va fi sarcina nucleară, care determină structura învelișului de electroni și numărul de electroni din ea. Este interesant! Știința nu stă pe loc și oamenii de știință au reușit să respingă dogma conform căreia atomul este cea mai mică particulă de elemente chimice. Astăzi lumea cunoaște quarks - constau din neutroni și protoni.